Welche Therapie hilft, hängt auch von der ursprünglichen Krebserkrankung ab. Zum Beispiel richten sich einige Medikamente gegen Merkmale, die nur bei bestimmten Tumorzellen vorhanden sind. Kommt eine Behandlung grundsätzlich infrage, hängt das weitere Vorgehen vom allgemeinen Gesundheitszustand eines Patienten ab. Berücksichtigt wird auch, wie viele Metastasen in welcher Körperregion festgestellt wurden – und ob es auch Absiedelungen außerhalb der Knochen gibt. Eine wichtige Frage ist: In welchem Verhältnis stehen Aufwand und Belastung zum erwartbaren Nutzen?Die vielen Therapiemöglichkeiten lassen sich in drei Gruppen zusammenfassen:
- Strahlentherapie
- Medikamente
- Operation
Patienten erhalten meist nicht nur eine Behandlung, sondern mehrere. Diese können zeitgleich oder nacheinander erfolgen. Damit diese Ansätze gut aufeinander abgestimmt sind, arbeiten Ärzte unterschiedlicher Fachrichtungen eng zusammen. Ob Patienten für die Behandlung ins Krankenhaus müssen, oder ob die Therapie ambulant erfolgt, hängt von der individuellen Situation ab.
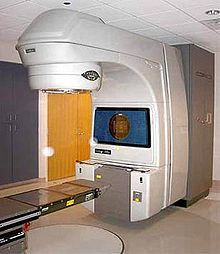
Strahlentherapie
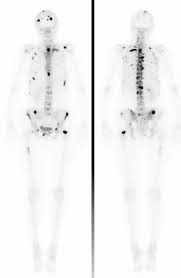
Knochenmetastasen können von “außen” oder von “innen” bestrahlt werden. Fachleute bezeichnen die Bestrahlung von “außen” als perkutane Strahlentherapie. Das bedeutet, dass energiereiche Strahlen von außen durch die Haut gelangen. So sollen Tumorzellen zum Absterben gebracht werden. Der Gegensatz dazu ist die sogenannte Radionuklidtherapie. Patienten werden dabei mit schwach radioaktiven Stoffen behandelt, die sie als Injektion erhalten. Diese Radionuklide lagern sich direkt im Knochen ein. Dort schädigen sie Tumorzellen und hemmen Entzündungen. Sowohl die Bestrahlung von “außen” als auch die Bestrahlung von “innen” sollen die Schmerzen von Betroffenen lindern.
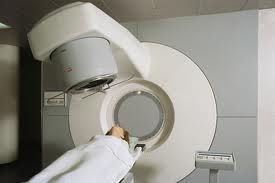 Perkutane Strahlentherapie: Bestrahlung von “außen” durch die Haut
Perkutane Strahlentherapie: Bestrahlung von “außen” durch die Haut
Radioonkologen bestrahlen Knochenmetastasen meist erst, wenn Symptome aufgetreten sind, vor allem Schmerzen. Für Schmerzen und drohende Brüche ist die Bestrahlung auf Grund des guten Therapieansprechens die Behandlung der ersten Wahl. Die Strahlentherapie kann mit anderen Behandlungen kombiniert werden, zum Beispiel mit Medikamenten.
Eine Bestrahlung kommt vor allem für die Behandlung einzelner, räumlich begrenzter Knochenmetastasen infrage. Finden sich viele Metastasen an mehreren unterschiedlichen Stellen des Körpers, wird eher auf eine medikamentöse Therapie oder eine Radionuklidtherapie gesetzt. Besonders bruchgefährdete Bereiche können zusätzlich bestrahlt werden. Eine Behandlung mit energiereichen Strahlen wirkt sowohl bei Knochensubstanz bildenden als auch bei Knochensubstanz auflösenden Metastasen. Üblicherweise erhalten Patienten eine perkutane Bestrahlung in spezialisierten Facharztpraxen oder in Ambulanzen von Krankenhäusern. Nach den Bestrahlungssitzungen können sich Betroffene meist wieder nach Hause begeben.
Grundsätzlich gibt es zwei Möglichkeiten, energiereiche Strahlung einzusetzen: Entweder erhalten Patienten einmalig eine hohe Dosis oder mehrfach entsprechend geringere Dosen. Bei einer Mehrfachbestrahlung wird die Gesamtdosis in der Regel auf zwei bis vier Wochen aufgeteilt. In Untersuchungen linderten beide Verfahrensweisen Schmerzen ähnlich gut. Jedoch ist die Wirkdauer der Schmerzlinderung und der Stabilisierungseffekt auf die Knochen bei Mehrfachbestrahlungen besser.
- Eine Wirkung ist allerdings frühestens fünf bis acht Tage nach Therapiebeginn zu erwarten, in der Regel dauert es ungefähr zwei Wochen. Diese Phase kann mit Schmerzmedikamenten überbrückt werden.
- Bis bestrahlte Knochen wieder stabiler sind, dauert es länger.Nebenwirkungen treten nur in geringem Umfang auf. Je kleiner die einzelnen Strahlendosen und das Bestrahlungsfeld sind, desto besser vertragen Patienten die Therapie. Wird viel Knochenmark mit bestrahlt, kann dies vorübergehend die Bildung gesunder Blutzellen beeinträchtigen.
Vorher Nacher
Bildbeschreibung: Vorher -Wirbelkörper zum Teil aufgelöst („graue Löcher“) , in der späteren Darstellung (Nacher) sind die „Löcher“ mit dichtem Knochenmaterial gefüllt („weißer Bereich“)
 Radionuklidtherapie
Radionuklidtherapie
Die Radionuklidtherapie ist eine besondere Form der Strahlentherapie. Ärzte setzen sie vor allem zur Behandlung von Schmerzen ein. Schwach radioaktive Substanzen lagern sich dabei ins Tumorgewebe ein. Häufig verwendeter Wirkstoff ist Samarium-153. Bei Prostatakrebs mit alleinigen Knochenmetastasen wird neuerdings auch Radium -223 in Spezialkliniken erfolgreich eingesetzt. Radionuklide wie Samarium ähneln natürlichen Knochenbausteinen und werden vor allem dort “eingebaut”, wo die Metastasen zu einem stark beschleunigten Knochenstoffwechsel und Umbauprozessen führen. Die Strahlung der Radionuklide schädigt die Tumorzellen und hemmt Entzündungen in direkter Umgebung.
Die strahlenden Stoffe werden Patienten in eine Armvene gespritzt. Meist kann die Therapie ambulant erfolgen. Bis Betroffene eine Wirkung spüren und Schmerzen nachlassen, dauert es etwa ein bis drei Wochen. Schmerzmittel können über diese Phase hinweghelfen.
Angewendet wird die Radionuklidtherapie vor allem, wenn über das ganze Skelettsystem verstreute Metastasen (disseminierte Metastasen) vorliegen. Räumlich begrenzte Tumorabsiedlungen werden eher von außen (perkutan) bestrahlt. Eine weitere Bedingung: Damit die strahlenden Teilchen in die Knochen eingebaut werden, müssen knochenaufbauende (osteoblastische) Vorgänge ablaufen.
Bei der Radionuklidtherapie achten Ärzte darauf, dass die Strahlenbelastung für das blutbildende Knochenmark nicht zu hoch ist. Lässt sich das, etwa bei sehr vielen Metastasen, nicht gewährleisten, kann das gegen die Radionuklid-Behandlung sprechen: Die Bildung gesunder Blutzellen würde zu stark beeinträchtigt. Dies könnte zu einer vorübergehenden Blutarmut, zu Problemen mit der Immunabwehr oder zu Störungen der Blutgerinnung führen. Deswegen ist eine Kontrolle des Blutbildes vor jeder Behandlung wichtig.
 Medikamente
Medikamente
Patienten mit Knochenmetastasen erhalten oft eine medikamentöse Behandlung. Das kann die gleiche Therapie sein, die schon gegen den Ursprungstumor eingesetzt wurde, zum Beispiel eine Chemotherapie. Bei Brustkrebs und Prostatakrebs kommt auch eine Antihormontherapie infrage. Zielgerichtete Medikamente, die gegen spezifische Eigenschaften von Tumorzellen wirken, können ebenfalls helfen. Sie stehen allerdings nicht bei allen Tumorarten zur Verfügung. Für Patienten sind zudem Arzneimittel wichtig, die gegen belastende Symptome wie Schmerzen wirken.
Bisphosphonate
Wichtig bei Bisphosphonatbehandlung!
Kiefer- und Zahnproblemen vorbeugen
Möglichst alle Zahn- und Zahnfleischprobleme vor der Bisphosphonat-Einnahme behandeln lassen! Und: Sehr gute Zahnpflege hilft, auf Dauer Probleme zu vermeiden.
Bisphosphonate sind Medikamente, die in die Stoffwechselprozesse der Knochen eingreifen. Für Patienten mit Knochenmetastasen sind diese Medikamente in der Regel ein wichtiger Teil der Behandlung.
Bisphosphonate schützen die Knochen vor weiterer Zerstörung. Indirekt lindern sie Schmerzen. Auch gegen Hyperkalzämie (zu viel Kalzium im Blut) helfen diese Wirkstoffe. Sie können als Infusion in eine Vene gegeben oder in Tablettenform eingenommen werden. Bisphosphonate greifen in den Kalziumstoffwechsel ein. Sie hemmen die Osteoklasten, also die Zellen im Körper, die am Abbau von Knochengewebe beteiligt sind.
Welche Nebenwirkungen auftreten, hängt davon ab, in welcher Form und welcher Dosis die Arzneimittel eingenommen werden. Bei Medikamenten zum Einnehmen (oralen Bisphosphonaten) kann es zu Magen-Darm-Beschwerden kommen. Patienten, die zu Sodbrennen neigen oder bei denen schon einmal Veränderungen an der Speiseröhrenschleimhaut festgestellt wurden, sollten ihren Arzt darüber informieren, weil Bisphosphonate als Tablette die Schleimhaut weiter reizen können. Betroffene berichteten bei intravenösen Bisphosphonaten häufig von grippeähnlichen Symptomen und Fieber. Diese halten für etwa einen Tag an. In die Vene gegebene Bisphosphonate können zudem zu Nierenfunktionsstörungen führen. Ärzte kontrollieren deshalb die Nierenwerte engmaschig. Sehr selten kann eine Behandlung zum Absterben von Teilen des Kieferknochens führen.
Für eine vorbeugende Anwendung – also vor dem Auftreten von Knochenmetastasen – sind Bisphosphonate in Deutschland bislang nicht zugelassen. Ihre Wirksamkeit ist bisher nicht zweifelsfrei belegt. Eine Anwendung ohne Zulassung bezeichnet man auch als Off-Label-Use, mehr dazu im Text “Krebsforschung“. Entscheiden sich Ärzte und Patienten dafür, sollten Betroffene mit ihrer Krankenkasse die Kostenübernahme vorab klären. Anders ist die Situation bei Knochenschwund (Osteoporose). Dabei handelt es sich häufig um eine Art Alterserkrankung der Knochen. Sie kann aber auch durch eine antihormonelle Therapie ausgelöst werden. Betroffene Krebspatienten können Bisphosphonate erhalten. Ein Beispiel ist die Vorbeugung und Behandlung von Osteoporose bei Brustkrebspatientinnen.
Chemotherapie: Einsatz hängt vom Tumor ab
Bei einer Chemotherapie erhalten Krebspatienten Medikamente, die das Zellwachstum hemmen. Eine Chemotherapie wird meist als Infusion, seltener in Tablettenform verabreicht. Die entsprechenden Medikamente bezeichnet man auch als Zytostatika.
Wann werden bei Betroffenen Zytostatika gegen Knochenmetastasen eingesetzt? Die Behandlung hängt von der ursprünglichen Krebsart ab: Nicht alle Tumorzellen sprechen gleich gut auf eine Chemotherapie an. Hat ein Patient bereits einmal eine Behandlung mit Zytostatika erhalten und ging es ihm danach besser, werden Ärzte die gleiche Therapie empfehlen. Blieb ein Zytostatikum schon einmal ohne Wirkung, ist es dagegen in der Regel nicht sinnvoll, es erneut zu verwenden.
Mit einer Chemotherapie lässt sich nicht nur das Tumorwachstum zeitweise bremsen. Wenn Knochenmetastasen ihre Größe verringern, üben sie weniger Druck auf das umliegende Gewebe aus: Daher kann eine Chemotherapie auch Schmerzen lindern. Allerdings wirkt eine Chemotherapie nicht nur gegen Tumorzellen, sondern auch gegen gesundes Gewebe, das sich ähnlich schnell teilt. Nebenwirkungen einer Chemotherapie können Haarausfall und Schleimhautprobleme sein. Wird das blutbildende Knochenmark beeinträchtigt, kann das zu Blutarmut und einer eingeschränkten Immunabwehr führen. Übelkeit und Erbrechen lassen sich durch Begleitmedikamente meist unterdrücken. Ob der Nutzen einer Chemotherapie diese Nebenwirkungen aufwiegt, ist eine schwierige Frage. Patienten müssen sie gemeinsam mit ihren Ärzten (Onkologen) klären.
Hormontherapie
Bei Brustkrebs, Gebärmutterkörperkrebs und Prostatakrebs hängt das Wachstum der Tumoren oft von Sexualhormonen ab, konkret von Östrogen und Progesteron bei Frauen und von Testosteron bei Männern.
Eine Antihormontherapie zielt darauf ab, die entsprechenden Hormone auszuschalten. Fachleute sprechen auch von endokriner Therapie. Sie setzt nicht allein am Knochen an, sondern beeinflusst alle Krebszellen im Körper. Bremst der Hormonentzug das Tumorwachstum, führt dies bei vielen Betroffenen zu einem Rückgang von Schmerzen. Sie kann die weitere Ausbreitung des Tumors für längere Zeit aufhalten. Betroffene erhalten ihre Medikamente entweder in Form von Tabletten oder als Depotspritzen, die in größeren Zeitabständen gegeben werden.
Bei Brustkrebs setzen Ärzte eine Antihormontherapie gegen Knochenmetastasen ein, wenn der Tumor hormonabhängig ist und die Krankheit langsam und ohne ausgeprägte Beschwerden fortschreitet. Frauen mit Gebärmutterkörperkrebs (Endometriumkarzinom), können mit Gestagenen behandelt werden. Diese Geschlechtshormone wirken als Gegenspieler des Östrogens. Möglich sind auch andere Antihormon-Medikamente. Infrage kommt auch eine Chemotherapie. Werden bei Prostatakrebspatienten Knochenmetastasen festgestellt, ist eine endokrine Behandlung meist die Therapie der Wahl. Allerdings werden Prostatakrebszellen nach einiger Zeit “hormontaub”: Der Tumor wächst wieder. Betroffene Männer benötigen dann eine andere Therapie.
Arzneimittel bei Hyperkalzämie
Wird Knochenmaterial abgebaut, können größere Mengen Kalzium freigesetzt und ins Blut abgegeben werden. Befindet sich zu viel Kalzium im Blut, spricht man von einer Hyperkalzämie. Erste Anzeichen können ein starkes Durstgefühl, eine erhöhte Urinausscheidung und Müdigkeit sein. Bei einem milden Verlauf können Beschwerden ausbleiben. Bei sogenannten hyperkalzämischen Krisen ist das anders. Übelkeit, Verwirrtheit, übermäßige Schläfrigkeit bis hin zu komatösen Zuständen sind möglich. Auftreten können auch Herzrhythmusstörungen. Ohne Therapie sind schwere Verläufe lebensgefährlich.
Ärzte versuchen, die Menge von gelöstem Kalzium im Blut wieder auf ein normales Niveau zu bringen. Ist der Kalziumspiegel nur leicht erhöht, ist die Behandlung ambulant möglich. Im Notfall müssen Patienten zuerst im Krankenhaus stabilisiert werden.
Häufig zur Behandlung eingesetzte Medikamente sind Bisphosphonate. Sie hemmen den Knochenabbau. Ihre Wirkung setzt allerdings mit einer Verzögerung von zwei bis vier Tagen ein. Meist erhalten Patienten mit Skelettmetastasen Bisphosphonate nicht erst bei Anzeichen einer Hyperkalzämie. Dies hat das Risiko für einen zu hohen Kalziumspiegel und schwere Komplikationen verringert. Weiterhin können Ärzte Hormone verabreichen, die in den Kalziumstoffwechsel eingreifen, etwa Kalzitonin oder Kortikosteroide (“Kortison”). Kalzitonin hat den Vorteil, dass es schneller wirkt als Bisphosphonate.
Monoklonale Antikörper
Eine weitere Gruppe von Medikamenten zur Behandlung von Knochenmetastasen sind sogenannte “targeted therapies“. In Deutschland ist bisher der Antikörper Denosumab zugelassen. Der Wirkstoff wird unter dem Markennamen Xgeva® zur Behandlung von Knochenmetastasen eingesetzt. Weitere vergleichbare Mittel werden in klinischen Studien getestet.
Denosumab vermindert die Bildung und Aktivität bestimmter Zellen. Letztlich führt das dazu, dass weniger Knochenmasse abgebaut wird. Knochenbrüche und andere schwerwiegende Folgen von Knochenmetastasen werden seltener.
Bei der Behandlung von Knochenmetastasen erhalten Patienten den Antikörper alle vier Wochen unter die Haut gespritzt. Sehr häufige Nebenwirkungen sind eine erschwere Atmung (Dyspnoe) und Durchfall. Sie treten bei mehr als zehn von 100 Patienten auf. Häufige unerwünschte Wirkungen können zudem Veränderungen im Mineralhaushalt des Körpers sein: Ein bis neun von 100 Behandelten weisen einen verringerten Kalzium- und Phosphatspiegel im Blut auf. Wie bei Bisphosphonaten wurden auch bei Patienten unter Behandlung mit Denosumab Gewebezerstörungen im Bereich des Kieferknochens (Kiefernekrosen) beobachtet.
Medikamentöse Schmerzbehandlung
Knochenmetastasen können starke Schmerzen verursachen. Dagegen stehen wirksame Medikamente zur Verfügung. Diese Arzneimittel verschaffen vielen Patienten eine deutliche Linderung. Ziel ist eine vollständige Schmerzfreiheit. Das wird allerdings nicht bei jedem Betroffenen erreicht. Besonders wichtig sind Schmerzmedikamente, solange andere Behandlungsansätze ihre volle Wirkung noch nicht entfaltet haben.
Die verschiedenen Arzneimittel wirken, indem sie die Ausschüttung schmerzauslösender Stoffe blockieren und die Wahrnehmung der Schmerzen verändern. Fachleute teilen die verfügbaren Arzneimittel in zwei Gruppen ein: Nicht-Opioid-Analgetika und Opioide. Zu den Nicht-Opioid-Analgetika gehören zum Beispiel Acetylsalicylsäure (ASS oder “Aspirin”), Paracetamol, Ibuprofen und Diclofenac. Bei starken Schmerzen oft wirksamere Schmerzmedikamente sind die Opioide. Der bekannteste Wirkstoff aus dieser Gruppe ist Morphium. Häufig verwendete Morphine sind z.B. Fentanyl oder Oxycodin. Zu den typischen Nebenwirkungen der Morphinbehandlung zählen Verstopfung und Müdigkeit. Morphine ,Nicht-opioide Schmerzmittel und sogenannte Co-analgetika werden entsprechend der Beschwerdesymptomatik oft kombiniert verabreicht.Welche Arzneimittel Patienten erhalten, hängt von ihrer Belastung ab. Die Weltgesundheitsorganisation WHO hat ein Stufenschema entwickelt, das für jede Schmerzstärke die geeigneten Medikamente vorsieht.
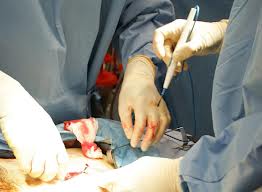
 Operation
Operation
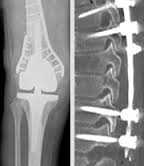
Bei Patienten mit Knochenmetastasen werden Operationen in Erwägung gezogen, wenn die Umbauprozesse des Skeletts zu einer erkennbaren Bruchgefahr geführt haben, oder wenn Brüche bereits aufgetreten sind. Ein chirurgischer Eingriff kann auch gegen Schmerzen und Lähmungen helfen. Üben beispielsweise die Metastasen Druck auf Nerven aus, so ist es möglich, diesen Zustand zu lindern. Ein Beispiel: Sind Nerven des Wirbelkanals durch die Metastasen eingeengt, kann durch eine Entfernung des einengenden Gewebes eine schnelle Entlastung der Rückenmarksnerven erreicht werden. Ist die Nervenschädigung noch nicht sehr ausgeprägt, bilden sich Schmerzen und auch Lähmungen schnell zurück.
Ob eine Operation möglich und sinnvoll ist, müssen Betroffene im Einzelfall mit ihren Ärzten (Neurochirurg, Orthopäde) klären. Gegen einen Eingriff können verschiedene Gründe sprechen. Bei einer zu großen Zahl an Metastasen wären zu viele belastende Eingriffe nötig. Bei manchen Patienten befürchten Chirurgen zudem Komplikationen. Sind Umbauprozesse im Skelett schon sehr fortgeschritten, erschwert das die Wund- und Knochenheilung. Die verringerte Stabilität der Knochen kann auch Probleme bereiten, wenn sie das Fixieren der Bruchstelle mit Schrauben oder Nägeln erschwert. Lässt sich ein Knochenbruch nicht mehr fixieren – und reicht es bei größeren Defekten nicht aus, sie entstandene Lücken mit Knochenzement zu verfüllen – muss eventuell auch an den Einsatz einer Prothese gedacht werden, beispielsweise eines künstlichen Gelenks.
Wie sinnvoll ein chirurgischer Eingriff ist, hängt zudem nicht nur von der chirurgischen Machbarkeit ab. Sehr schwer kranke Patienten sehen sich auch mit dem Problem konfrontiert, dass die Wundheilung lange dauert und es Zeit braucht, bis die Eingriffe am Knochen wieder zu mehr Stabilität führen. In dieser Zeit ist ihre Lebensqualität unter Umständen durch die Folgen eines Eingriffs stärker eingeschränkt, als es durch den Nutzen des Eingriffs zu rechtfertigen ist. Geht es Betroffenen sehr schlecht, muss auch geklärt werden, ob ihr Zustand einen Eingriff überhaupt zulässt.
Fällt aber die Entscheidung zur Operation, gilt: Welches Verfahren Chirurgen anwenden, hängt von der konkreten Situation ab. Allgemein gilt: Die Ärzte versuchen, die Metastasen so vollständig wie möglich zu entfernen und dabei möglichst schonend vorzugehen. Zusätzlich wird die entsprechende Stelle je nach Situation noch bestrahlt, um den Behandlungserfolg längerfristig zu sichern.
Orthesen, Schienen, Korsetts
Ob instabile Knochen vorübergehend oder auf Dauer durch eine Schienung gestützt werden können, hängt sehr stark von der individuellen Situation ab. Es gibt die Möglichkeit, zum Beispiel die Wirbelsäule durch Spezial-Korsetts zu entlasten, die von Orthopädietechnikern individuell angepasst werden. Allerdings ist die äußerliche Stabilisierung durch Schienen oder individuell angepasste “Orthesen” im Alltag manchmal unbequem und belastend für Betroffene. Nach einer Operation kann die zeitweilige Schienung aber die Zeit überbrücken, bis die Wund- und Knochenheilung abgeschlossen ist. Wurde ein Knochen durch Nagelung oder Metallplatten stabilisiert, ist oft auch dies nicht notwendig.
Quelle: Text enthält Auszüge aus www.krebsinformationsdienst.de/tumorarten/metastasen/knochenmetastasen-behandlung.php
Ein besonderer Dank ergeht an alle Kollegen und Institutionen die ihre Bildmaterialien der Öffentlichkeit zur Verfügung stellen.


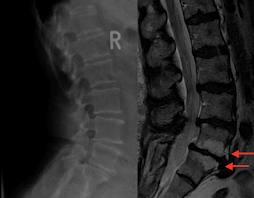 Diagnose von Knochenmetastasen
Diagnose von Knochenmetastasen Perkutane Strahlentherapie: Bestrahlung von “außen” durch die Haut
Perkutane Strahlentherapie: Bestrahlung von “außen” durch die Haut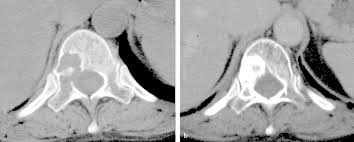
 Radionuklidtherapie
Radionuklidtherapie Medikamente
Medikamente Operation
Operation